醫(yī)療器械行業(yè)對(duì)產(chǎn)品的安全和有效性要求極高,廠商需嚴(yán)格遵循法規(guī)和標(biāo)準(zhǔn)。以下通過(guò)3個(gè)關(guān)鍵流程圖,幫助醫(yī)療器械廠商清晰梳理工作須知。
一、產(chǎn)品研發(fā)與注冊(cè)流程圖
1. 需求分析:明確臨床需求與市場(chǎng)定位。
2. 設(shè)計(jì)開(kāi)發(fā):進(jìn)行概念設(shè)計(jì)、詳細(xì)設(shè)計(jì)、原型制作。
3. 驗(yàn)證與確認(rèn):包括實(shí)驗(yàn)室測(cè)試、動(dòng)物實(shí)驗(yàn)(如適用)、臨床評(píng)價(jià)。
4. 注冊(cè)申報(bào):準(zhǔn)備技術(shù)文檔,提交國(guó)家藥品監(jiān)督管理局(NMPA)審批。
5. 取得注冊(cè)證:通過(guò)審核后獲得產(chǎn)品上市許可。
說(shuō)明:整個(gè)過(guò)程需遵循質(zhì)量管理體系(如ISO 13485),確保數(shù)據(jù)真實(shí)完整。
二、生產(chǎn)質(zhì)量管理流程圖
1. 原材料采購(gòu):選擇合格供應(yīng)商,進(jìn)行進(jìn)貨檢驗(yàn)。
2. 生產(chǎn)過(guò)程控制:依工藝規(guī)程操作,實(shí)施過(guò)程檢驗(yàn)。
3. 成品檢驗(yàn):按標(biāo)準(zhǔn)進(jìn)行全項(xiàng)目檢測(cè),合格后放行。
4. 儲(chǔ)存與運(yùn)輸:確保環(huán)境條件符合產(chǎn)品要求。
5. 追溯管理:建立唯一標(biāo)識(shí)(UDI)系統(tǒng),實(shí)現(xiàn)全生命周期可追溯。
說(shuō)明:廠商需建立并維護(hù)質(zhì)量管理體系,定期接受飛行檢查和體系考核。
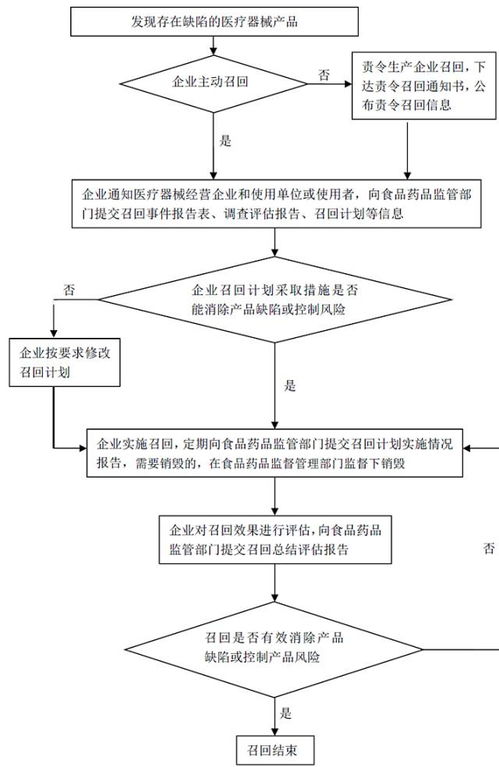
三、上市后監(jiān)督與維護(hù)流程圖
1. 不良事件監(jiān)測(cè):收集、評(píng)估和報(bào)告產(chǎn)品相關(guān)不良事件。
2. 售后服務(wù):提供技術(shù)支持和培訓(xùn),處理客戶投訴。
3. 定期評(píng)估:進(jìn)行產(chǎn)品風(fēng)險(xiǎn)再評(píng)價(jià)和臨床跟蹤。
4. 變更管理:如有設(shè)計(jì)、工藝等變更,需重新評(píng)估并報(bào)備。
5. 產(chǎn)品召回:發(fā)現(xiàn)問(wèn)題時(shí)及時(shí)啟動(dòng)召回程序。
說(shuō)明:上市后監(jiān)督是法規(guī)強(qiáng)制要求,廠商應(yīng)建立主動(dòng)監(jiān)測(cè)體系,保障患者安全。
醫(yī)療器械廠商需以法規(guī)為準(zhǔn)繩,以質(zhì)量為核心,通過(guò)系統(tǒng)化流程確保產(chǎn)品安全有效,并承擔(dān)全生命周期責(zé)任。建議廠商結(jié)合自身產(chǎn)品特點(diǎn),細(xì)化流程,加強(qiáng)人員培訓(xùn),以提升合規(guī)性和市場(chǎng)競(jìng)爭(zhēng)力。